- 新食品原料申報
- 申報流程
- 政策法規(guī)
- 經(jīng)驗(yàn)分享
- 原料目錄
- 轉(zhuǎn)基因生物
- 聯(lián)系我們
- 電話:13241188166
- 座機(jī):010-56216670
-

掃一掃,添加微信
麥角硫因與NMN:中國申報之路的異同與啟示
2025-07-29
在健康產(chǎn)業(yè)蓬勃發(fā)展的當(dāng)下,麥角硫因與NMN作為備受關(guān)注的功能性成分,其在中國的申報進(jìn)程始終牽動著市場神經(jīng)。二者雖同為抗衰老領(lǐng)域的“明星成分”,但申報之路卻呈現(xiàn)出截然不同的軌跡,背后折射出我國對功能性原料的監(jiān)管邏輯與市場規(guī)范思路。
一、NMN的申報困局:從熱潮到受限
NMN(β-煙酰胺單核苷酸)因潛在的抗衰老功效一度引爆市場,卻在國內(nèi)遭遇了明確的監(jiān)管限制。其申報歷程的核心矛盾在于“身份缺失”與“市場失序”的相互疊加。
從申報流程來看,NMN曾嘗試以食品添加劑身份突破。2023年1月,國家衛(wèi)生健康委員會受理了NMN作為食品添加劑新品種的申請,但僅4個月后便駁回該申請。按照我國《食品添加劑新品種管理辦法》要求,需提交原料來源、生產(chǎn)工藝、安全性評估、使用范圍及劑量等全套材料,而NMN因缺乏足夠的國內(nèi)食用歷史數(shù)據(jù),且安全性評估未能完全滿足標(biāo)準(zhǔn),最終未能通過審查。
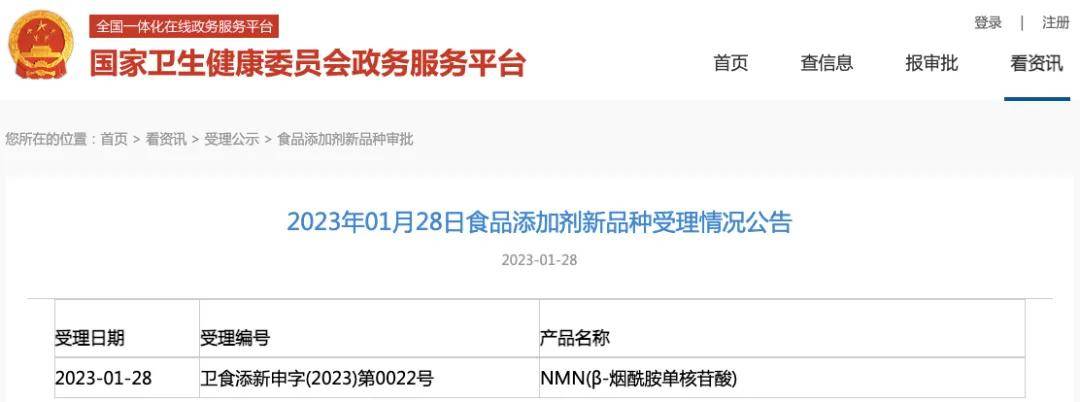
2023年1月 NMN受理公告
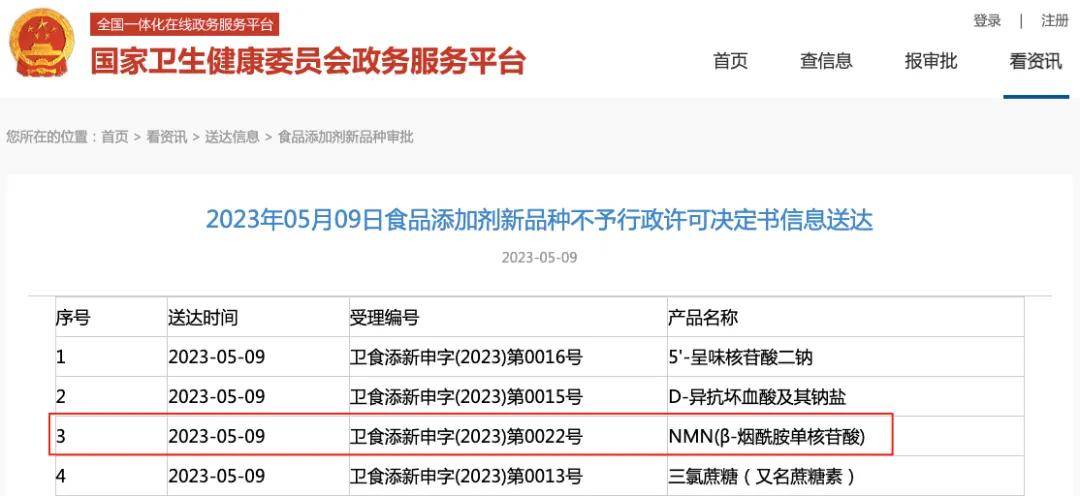
2023年5月 NMN不予行政許可公告
更深層的問題在于市場混亂對申報的反噬。在未獲合法身份的情況下,大量企業(yè)涌入NMN市場,產(chǎn)品質(zhì)量參差不齊——檢測數(shù)據(jù)顯示,多款熱銷產(chǎn)品的NMN含量遠(yuǎn)低于宣傳,甚至完全不含該成分。同時,“不老藥”等夸大宣傳盛行,不僅誤導(dǎo)消費(fèi)者,更引發(fā)監(jiān)管部門對其合規(guī)性的高度警惕。2024年3月,海關(guān)總署加強(qiáng)對含NMN成分產(chǎn)品的監(jiān)管,標(biāo)志著NMN當(dāng)前未獲合法身份,在國內(nèi)食品、保健食品領(lǐng)域的申報通道暫不開放。
二、麥角硫因的申報進(jìn)展:在規(guī)范中探索
與NMN不同,麥角硫因的申報路徑更聚焦于“新食品原料”,目前正處于積極推進(jìn)階段,但其過程同樣面臨挑戰(zhàn)。
2024年5月,國家衛(wèi)生健康委首次受理麥角硫因作為新食品原料的申請,此后2025年一季度又有企業(yè)跟進(jìn)申報。按照《新食品原料安全性審查管理辦法》,申報需經(jīng)歷研制報告、成分分析、安全性評估、生產(chǎn)工藝等材料準(zhǔn)備、受理、技術(shù)審查、審批公布等環(huán)節(jié),常規(guī)周期從受理到審批約15個月。
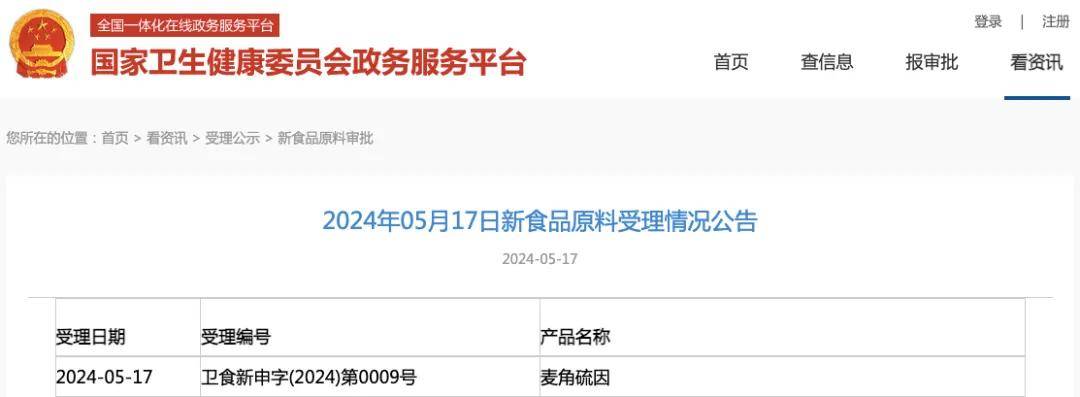
2024年5月 麥角硫因首次受理公告
但麥角硫因的特殊性延長了審批進(jìn)程。當(dāng)前申報產(chǎn)品部分為天然來源,部分采用合成生物學(xué)生產(chǎn),后者涉及轉(zhuǎn)基因微生物,需額外提交《食品加工用遺傳修飾微生物安全性評價申報材料》。這一環(huán)節(jié)對安全性論證的要求更為嚴(yán)苛,可能導(dǎo)致審查周期拉長。不過,其優(yōu)勢在于國際認(rèn)可度較高,已被美國、歐洲、日本等批準(zhǔn)作為食品原料,積累了豐富的安全數(shù)據(jù),為國內(nèi)審批提供了參考。
此外,麥角硫因在化妝品領(lǐng)域的合法應(yīng)用為其積累了市場基礎(chǔ)。雅詩蘭黛、伊麗莎白雅頓等品牌將其作為抗氧化成分廣泛使用,這種“妝食同源”的特性,一定程度上降低了市場對其安全性的顧慮,也為其食品領(lǐng)域的申報增添了合理性。
三、申報對比與行業(yè)啟示
麥角硫因與NMN的申報之路,折射出我國對功能性原料的監(jiān)管邏輯:以安全性為核心,以市場規(guī)范為前提,以合法身份為基礎(chǔ)。
從共性來看,二者都需跨越“安全性評估”與“功效宣稱規(guī)范”兩道關(guān)。NMN的教訓(xùn)在于,市場混亂與夸大宣傳透支了監(jiān)管信任,而麥角硫因若想避免重蹈覆轍,需在申報期間就推動行業(yè)自律——企業(yè)需嚴(yán)控產(chǎn)品質(zhì)量,避免功效炒作,同時配合監(jiān)管部門完善數(shù)據(jù)積累。
從差異來看,麥角硫因的優(yōu)勢在于多元來源與國際合規(guī)基礎(chǔ),而NMN的困境則源于“未批先售”的市場亂象。這提示相關(guān)企業(yè):功能性原料的申報需循序漸進(jìn),在獲得合法身份前,應(yīng)避免盲目擴(kuò)張市場;監(jiān)管部門則需平衡“風(fēng)險防控”與“產(chǎn)業(yè)創(chuàng)新”,在嚴(yán)守安全底線的前提下,加快審批流程的透明度與效率。
未來,麥角硫因能否復(fù)制國際市場的成功,NMN是否有機(jī)會通過新的申報路徑回歸,都將取決于“安全數(shù)據(jù)”與“市場規(guī)范”的雙重支撐。對于功能性成分而言,合法合規(guī)的申報之路或許漫長,但唯有如此,才能真正實(shí)現(xiàn)從“熱門概念”到“市場價值”的可持續(xù)轉(zhuǎn)化。
新食品原料申報的成功,離不開資料規(guī)范與全流程把控。近年審批效率提升,但因預(yù)評估不足、資料不當(dāng)?shù)葘?dǎo)致的延期、不予許可仍頻發(fā)。在國家衛(wèi)健委公布的新食品原料及實(shí)質(zhì)等同名單中,北京中健天行醫(yī)藥憑借多款產(chǎn)品獲批的成績,在行業(yè)內(nèi)積累了極為豐富的成功申報經(jīng)驗(yàn),項(xiàng)目實(shí)力名列前茅。我們可為申報的新食品原料提供全面評估與分析,量身定制經(jīng)濟(jì)、可行且有保障的申報方案。歡迎相關(guān)申報企業(yè)來電交流!
